العدد الذري والكتلي للعناصر الكيميائية
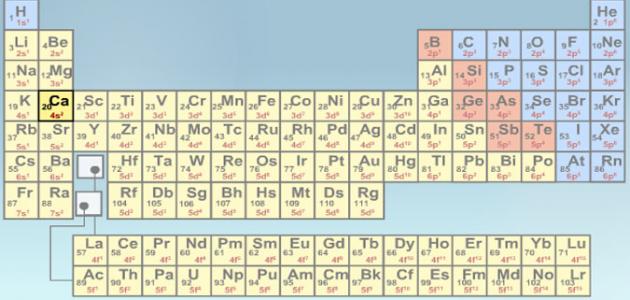
العدد الذري والكتلي للعناصر الكيميائية، يرتبط العدد الذري باسم العنصر، أي أن جميع الذرات التي لها رقم واحد تنتمي إلى عنصر مكافئ، يحدد الرقم ترتيب العنصر على الطاولة، أما بالنسبة لـ 12، فهي كتلة العنصر (مجموع البروتونات والنيوترونات).
محتويات المقال
العدد الذري والكتلي للعناصر الكيميائي
- الهيدروجين، العدد الذري (١)، والعدد الكتلي (٧).
- الهيليوم، العدد الذري (٢)، والعدد الكتلي (٢).
- ليثيوم، العدد الذري (٣)، والعدد الكتلي (٢).
- بيريليوم، العدد الذري (٤)، والعدد الكتلي (٣).
- بورون، العدد الذري (٥)، والعدد الكتلي (٧).
- كربون، العدد الذري (٦)، والعدد الكتلي (٨).
- نيتروجين، العدد الذري (٧)، والعدد الكتلي (٢).
- أكسجين، العدد الذري (٨)، والعدد الكتلي (٩).
- نيون، العدد الذري (١٠)، والعدد الكتلي (٦).
- صوديوم، العدد الذري (١١)، والعدد الكتلي (٢).
- ماغنسيوم، العدد الذري (١٢)، والعدد الكتلي (٦).
- ألومنيوم، العدد الذري (١٣)، والعدد الكتلي (٢).
- سيليكون، العدد الذري (١٤)، والعدد الكتلي (٣).
- فوسفور، العدد الذري (١٥)، والعدد الكتلي (٢).
- كبريت، العدد الذري (١٦)، والعدد الكتلي (٥).
- كلور، العدد الذري (١٧)، والعدد الكتلي (٢).
- أرجون، العدد الذري (١٨)، والعدد الكتلي (١).
- بوتاسيوم، العدد الذري (١٩)، والعدد الكتلي (١).
- كالسيوم، العدد الذري (٢٠)، والعدد الكتلي (٤).
- سكانديوم، العدد الذري (٢١)، والعدد الكتلي (٨).
- تيتانيوم، العدد الذري (٢٢)، والعدد الكتلي (١).
- فانديوم، العدد الذري (٢٣)، العدد الكتلي (١).
- كروم، العدد الذري (٢٤)، والعدد الكتلي (٦).
- منجنيز، العدد الذري (٢٥)، والعدد الكتلي (٩).
- حديد، العدد الذري (٢٦)، والعدد الكتلي (٢).
- كوبالت، العدد الذري (٢٧)، والعدد الكتلي (٩).
- نيكل، العدد الذري (٢٨)، والعدد الكتلي (٢).
- نحاس، العدد الذري (٢٩)، والعدد الكتلي (٣).
- زنك، العدد الذري، (٣٠)، والعدد الكتلي (٤).
- جاليوم، العدد الذري (٣١)، والعدد الكتلي (١).
- جيرمانيوم، العدد الذري، (٣٢)، والعدد الكتلي (١).
- زرنيخ، العدد الذري، (٣٣)، والعدد الكتلي (٢).
- سيلينيوم، العدد الذري (٣٤)، والعدد الكتلي (٣).
- بروم، العدد الذري، (٣٥)، والعدد الكتلي (١).
- كربتون، العدد الذري، (٣٦)، والعدد الكتلي (٢).
- روبيديوم، العدد الذري (٣٧)، والعدد الكتلي (٣).
- سترانشيوم، العدد الذري، (٣٨)، والعدد الكتلي (١).
- إيتيريوم، العدد الذري، (٣٩)، والعدد الكتلي (٢).
تعريف العدد الذري والعدد الكتلي
- يتم تعريف العدد الذري على أنه عدد البروتونات داخل الذرة، ويُشار إليه بالرمز (Z). إنه الرمز (أ)، ويمكن تحديد نوع العنصر والخصائص الخاصة بيه من خلاله.
- أما بالنسبة للعد الكتلي، فقد تم تعريفه أنه مجموع من البروتونات والنيوترونات المتوافقة مع المعادلة الرياضية التالية عدد الكتلي = كمية البروتونات + كمية النيوترونات، ويُشار إليها بالرمز (أ).
- ما يجب ملاحظته هو أن الجدول العصري رتب العناصر على زيادة العدد الذري.
- الذي اكتشفه العالم هنري موسلي، لأن الرقم موضوع في أعلى عنصر داخل الجدول، وبالتالي يتم وضع رقم الكتلي أسفل العنصر.
- عند التعبير عن العنصر، يتم وضع العدد والكتلة على يسار العنصر.
- بحيث يتم التعبير عن رقم الكتلي، بواسطة رقم صغير الحجم أعلى العنصر وبالتالي يعبر العدد الذري عن رقم يتم وضعه على شكل رقم صغير ولكن أسفل العنصر.
- وذلك لأن كتلة الإلكترونات لا تدخل في حساب العدد الكتلي، لأن كتلته صغيرة للغاية، حوالي 1800 مرة أصغر من كتلة البروتون.
- ويساوي العدد الكتل لأي ذرة تساوي الكتلة إلى أقرب عدد صحيح.
- تعتبر النظائر المختلفة للعنصر لها أعداد مالية مختلفة لأنها تحتوي على أعداداً مختلفة من النيوترونات.
- وما يجب ملاحظته أن إضافة بروتون إلى الذرة ينتج عنه تشكيل عنصر بديل، كما هو الحال مع إضافة نيوترون إلى ذرة، فإنه يخلق ما يشار إليه بالنظائر.
العلاقة بين العدد الذري للعنصر وسلوكه الكيميائي
- غالبًا ما يتم تحديد الخصائص الكيميائية للعنصر من خلال معرفة رقمه داخل الجدول، لأن كمية البروتونات تساوي كمية الإلكترونات داخل الذرة المحايدة.
- ومن خلال معرفة كمية الإلكترونات يمكن حساب التوزيع الإلكتروني للعنصر، وفهم طبيعة إلكترونات التكافؤ في المدار الأخير.
- لأن طبيعة تلك الإلكترونات تحدد قدرة الذرة على مشاركة إلكتروناتها ولإنشاء روابط كيميائية أثناء التفاعلات الكيميائية.
أمثلة على حساب العدد الذري والعدد الكتلي
يتم استخدام العدد الذري ورقم الكتلي، من أجل تكوين صورة كاملة للذرة وبالتالي العناصر، من حيث الخصائص، والطريقة التي تحتفظ بها النواة بالذرات، ومعرفة كمية البروتونات والإلكترونات، والنيوترونات لكل عنصر، وبالتالي فإن ما يلي أمثلة توضيحية:
1- مثال (1)
للذرة رقم 9 ورقم نيوتروناتها هو تسعة عشر، فما هي كمية البروتونات وكمية الإلكترونات وبالتالي عدد النيوترونات في معهم؟
- الحل، كمية البروتونات هي 9، لأن كمية البروتينات عادة ما تكون كافية لعدد البروتونات.
- كمية الإلكترونات 9، لأن كمية البروتونات يساوي كمية الإلكترونات داخل الذرة المحايدة.
- كمية النيوترونات هي 10، لأنه غالبًا ما يتم الحصول على كمية النيوترونات عن طريق طرح العدد الذري من العدد الكتلي، وهذا يعني أن (عدد البروتونات + عدد النيوترونات) – (عدد البروتونات) = كمية النيوترونات.
2- مثال (2)
- ما هي كمية النيوترونات الموجودة في ذرة الكلور (Cl) التي يبلغ عددها 17 وعدد النوى الذي هو 35؟
- الحل، بما أن العدد يساوي كمية البروتينات، وبالتالي فإن عدد الكتلي = كمية البروتونات + كمية النيوترونات، إذن 35 = 17 + كمية النيوترونات وبالتالي كمية النيوترونات = 35 – 17 = 18 نيوترون.
3- مثال (3)
- ذرة صوديوم، عددها 11، ما هي كمية البروتونات والإلكترونات؟
- الحل، وتجدر الإشارة إلى أن العدد الذري = كمية البروتونات = كمية الإلكترونات داخل الذرة المحايدة، وبالتالي فإن كمية البروتونات تساوي 11 وبالتالي فإن عدد الإلكترونات يساوي 11 أيضًا.
4- مثال (4)
- ما هي كمية البروتونات والنيوترونات والإلكترونات داخل الذرة المحايدة لبورون الطقس (B105) والزئبق (Hg19980)؟
- الحل: العدد داخل ذرة البورون = 5، وبالتالي عدد البروتونات = 5 وبالتالي عدد الإلكترونات = 5، وبالتالي عدد النيوترونات = 5.
- العدد في ذرة الزئبق = 80، إذن عدد البروتونات = 80، كمية الإلكترونات = 80، وبالتالي عدد النيوترونات 119.
أهم المعلومات الخاصة بالعدد الذري والعدد الكتلي
- قام مندليف بترتيب العناصر الكيميائية المعروفة بما يتفق مع تشابهها في الخواص الكيميائية وقد لوحظ أن ترتيبها المتوافق مع الكتلة أدى إلى بعض الاختلافات.
- اليود والتيلوريم، إذا تم ترتيبها وفقًا للكتلة، فقد يتم وضعها بشكل خاطئ ولكن عندما يتم ترتيبها وفقًا (لعدد البروتونات)، أدى تتطابق خصائصها الكيميائية مع الترتيب
- العدد الذري يساوي 1 للهيدروجين لأن نواته تحتوي على بروتون واحد.
- والهيليوم العدد الذري 2 نواته بروتونان وزوجان من النيوترونات.
- ثم يأتي الليثيوم داخل الجدول، ويوجد في نواته 3 بروتونات بالإضافة إلى 4 نيوترونات.
- وهكذا يزداد عدد العناصر حتى العناصر الثقيلة مثل الرصاص (العدد الذري 82) واليورانيوم العدد الذري 92
- إلى جانب الرقم Z، وهو عدد البروتونات، نحن أيضًا مهتمون بالكيمياء والفيزياء.
- الكتلة A هي أن مجموع البروتونات والنيوترونات داخل النواة الذرية، A يسمى العدد الكتلي.
- لقد لوحظ أن العدد المتساوي من البروتونات وبالتالي عدد النيوترونات يعمل على استقرار النواة، وعلى وجه الخصوص، نكتشف ذلك بالنسبة للعناصر العشرين الأساسية الموجودة في الجدول.
- بالجدول.
- بعد ذلك تحتاج النواة إلى المزيد من النيوترونات للحفاظ على استقرار النواة وذلك لمعادلة قوى التنافر المتزايدة بين البروتونات (النيوترونات متعادلة كهربائيًا).
- إذا كانت النواة غير مستقرة فهي مشعة، قد نجد من بين النظائر المختلفة لمكون ما، شيئًا مستقرًا أو غير مستقر، على سبيل المثال الكربون -12 مع 6 بروتونات + 6 نيوترونات في مستقر، بينما الكربون 14 وله 6 بروتونات + 8 نيوترونات هو غير مستقر.
- بغض النظر عما إذا كان العنصر مشعًا أم لا، فإن خواصه الكيميائية لا تتأثر.
- يبدو أن التغييرات داخل أطياف العنصر تعتمد على الارتفاع في الرقم Z.
- وقد أوضح هنري موسلي هذه الاختلافات في النهاية في عام 1913.
- قام موسلي فحص الخطوط الطيفية المنبثقة من الذرات المثارة وحدد أنها تقبلها على أنها صحيحة مع نموذج بور، من الذرة.
- كما رأى أن تردد خطوط الطيف الخاصة بالعناصر المختلفة يتناسب طرديًا مع مربع الرقم Z.
وفي النهاية نكون قد ذكرنا كافة المعلومات التي قد ترغب في معرفتها حول العدد الذري والكتلي للعناصر الكيميائية.