الأنود في الخلية الكهروكيميائية قطب يحدث عندة تفاعل
محتويات المقال
الأنود في الخلية الكهروكيميائية قطب يحدث عنده تفاعل
- القطب هو مكون أساسي للخلية الكهروكيميائية، حيث تلامس الإلكتروليت ويعرف باسم القطب، ومن ثم يعمل هذا القطب كمعدن يسير خلاله تيار الكهرباء.
- وبهذا يمكننا أن نقول أنه سطح مناسب للتفاعل بين المحلول الإلكتروليتي والمعدن عن طريق الأكسدة والاختزال.
- وهذا القطب يكون شبه موصل يحدد نقل الشحنات داخل الخلية، وفي عملية الأكسدة يفقد إلكترونات ويمر عبر الإلكتروليت.
- وفي عملية الاختزال يكتسب إلكترونات من الإلكتروليت، ويختلف التفاعل الحادث باختلاف نوع الخلية الكهروكيميائية والتحليل الكهربائي والكيميائي الحادث عند القطب.
اقرأ أيضا: ما هو الصدأ؟
ما هو الأنود؟
- في فرع الكيمياء الكهربية يعرف الأنود بأنه نقطة تحدث عندها تفاعل أكسدة؛ حيث تعمل الأيونات السالبة على إخراج إلكترونات والتفاعل مع الإلكتروليت وسرعان ما تتحرك تلك الإلكترونات في الدائرة.
- حيث يعتبر الأنود لوحة تحتوي على شحنات موجبة زائدة، ويختلف وجوده باختلاف نوع الخلية الكهروكيميائية.
ما هو الكاثود؟
- على عكس الأنود يكون الكاثود قطب أو نقطة تحدث عندها تفاعل اختزال وتكون الشحنة سالبة؛ حيث يتم توفير طاقة كهربائية تعمل على تحليل المركبات الكيميائية.
- ويكون هذا الكاثود ساخنًا عندما يحدث انبعاث حراري وإصدار إلكترونات في الخيوط، ويكون باردًا إذا كانت الإلكترونات أكثر من الصادرة عن الانبعاث الحراري.
الفرق بين الأنود والكاثود
- الأنود يحدث عنده أكسدة وفقد إلكترونات والكاثود يحدث عنده اختزال واكتساب إلكترونات.
- الأنود قطب موجب تسير إليه الكهرباء والكاثود قطب سالب تتدفق منه الكهرباء، وهذا في غالبية الخلايا الكهروكيميائية، ويمكن القول بأن الأنود متبرع بالإلكترونات والكاثود مستقبل لها.
- تختلف الشحنات لكل منهما أحياناً باختلاف نوع الخلايا.
- في خلية التحليل الكهربي يكون الأنود موجبًا يجذب الإلكترونات السالبة، والكاثود سالبًا يجذب الإلكترونات الموجبة.
- أما في الخلايا الجلفانية يكون الأنود سالبًا يجذب الإلكترونات إيجابياً، والكاثود موجبًا يجذب الإلكترونات السالبة.
في أي قطب تحدث الأكسدة
- يحدث تفاعل أكسدة عند الأنود في خلية التحليل الكهربي.
- يحدث تفاعل اختزال عند الكاثود في خلية التحليل الكهربي.
- يتحول الأنود إلى كاثود في الخلية الجلفانية أو الڤولتية.
- يتحول الكاثود إلى أنود في الخلية الجلفانية أو الڤولتية.
- المصطلح الشائع بأن تدفق الإلكترونات يكون فقط عند الكاثود، والأنود تحدث دائماً عنده تفاعلات أكسدة مصطلح خطأ؛ حيث تختلف الشحنات والوظائف باختلاف نوع الخلايا.
أنواع الأنود
- أنود الكادميوم.
- أنود النيكل.
- أنود الزنك.
- أنود الرصاص.
- أنود الجرافيت أو الكربون أو الفحم.
- أنود القصدير.
- أنود النحاس الأصفر.
- الأنود الخالي من الأكسجين للنحاس.
- الأنود الإلكتروليتي للنحاس.
- أنود نحاس الفوسفور.
- أنود التيتان البلاتينيزد.
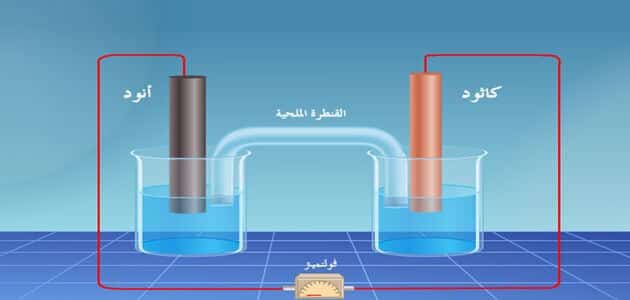
ما هي الخلية الكهروكيميائية؟
- هي واحدة من مصادر التيار الكهربي حيث تحدث تفاعلات تعمل على تحويل الطاقة الكيميائية إلى طاقة كهربية عن طريق تفاعلات الأكسدة والاختزال مع المحاليل الإلكتروليتية.
- وهذا يتطلب مصادر خارجية لإتمام التفاعل، مثل طاقة جيبس الحرة للنظام والطاقة الخارجية المستمدة منه.
كما أدعوك للتعرف على: أكسيد الألومنيوم واستخداماتها
أنواع الخلية الكهروكيميائية
- الخلايا الجلفانية أو الڤولتية وتعمل على تحويل الطاقة الكيميائية إلى كهربية تحويلًا مباشرًا بحدوث تفاعلات أكسدة واختزال.
- حيث يكون كل قطب عنده أيون حر وموصل معدن ويسمى كل واحد بنصف خلية، ومن أشهر أمثلتها خلية دانييل يستخدم فيها الزنك والنحاس في تفاعلات الأكسدة والاختزال.
- السلسلة الكهروكيميائية وهي عبارة عن سلسلة نشاط كيميائي تنتج من جهود أقطاب قياسية بقياس جهد القطب المنفرد في الظروف القياسية نسبةً إلى القطب القياسي للهيدروجين.
- ومن هنا تترتب الأقطاب الكهربية المعدنية وغير المعدنية لتنتج سلسلة كهروكيميائية.
- خلية التحليل الكهربي وتغمس فيها الأقطاب الكهربية في محلول إلكتروليتي به كاتيونات وأنيونات، ثم يدخل تيار كهربائي يعمل على تحرير الإلكترونات واتجاه كل منها إلى القطب المناسب.
- ومن هنا تحدث عملية الأكسدة والاختزال، وأشهرها تحليل كلوريد الصوديوم لأعلى من 801 درجة مئوية.
كما يمكنكم الاطلاع على: بحث شامل عن الحماية الكاثودية
وإلى هنا نكون قد وصلنا إلى نهاية مقال الأنود في الخلية الكهروكيميائية قطب يحدث عنده تفاعل والذي وضحنا فيه الخلايا الكهروكيمائية وأنواعها المختلفة والأقطاب المختلفة للأنود والكاثود وأنواع الأنود المختلفة.