ما هي الذرة المثارة؟
ما هي الذرة المثارة؟، تعرف الذرة بأنها أصغر مادة يمكن الحصول عليها من مادة ما عند توزيعها، وهي محايدة إذا انكسرت الذرة، فسيتم شحن أجزائها المختلفة، والذرة هي أيضًا حجر الزاوية في الكيمياء، فهي أصغر مكون في المادة يمكن أن يظهر خصائص كيميائية.
محتويات المقال
مكونات الذرّة
- عندما تنظر إلى الذرة نفسها عن كثب، يمكنك تحديد تركيبها، تتكون من بروتونات موجبة الشحنة، ونيوترونات محايدة، و إلكترونات سالبة الشحنة، وهو نوع العنصر الذي يحدد كمية كل عنصر.
- عادة ما تكون معظم الذرة في الفراغ، وهناك سحابة من الإلكترونات بداخلها، ومقارنة بحجم الذرة بأكملها، فهي تدور حول مساحة صغيرة، وهذا الفضاء يسمى النواة.
- ويحتوي على البروتونات والنيوترونات، لذلك فهو موجب الشحنة، كتلة الإلكترون أقل من كتلة النواة.
- لأنه أخف جسيم موجود في الطبيعة، ولأن النواة مشحونة إيجابياً والإلكترونات التي تدور حولها مشحونة سالبة، فهذا يعني أن هناك تبادل قوة المجال الكهربائي بين النواة والإلكترونات، مما يجذب الإلكترونات إلى نواة.
1- البروتون
- البروتون هو جسيم دون ذري شحنة موجبة تساوي شحنة الإلكترون، وكتلته 1.67262 × 10-27 كجم، أي 1836 ضعف كتلة الإلكترون، عدد البروتونات هو رقم يمثل العدد الذري للعنصر.
- وهذا أيضًا هو السبب الذي يحدد ترتيب العناصر في الجدول الدوري، فحتى نهاية القرن العشرين، كان الناس يعتقدون دائمًا أن البروتونات هي جسيمات أولية.
- بعبارة أخرى، لا يوجد شيء فيه، ولا يمكن تقسيمه، لأن علماء فيزياء الجسيمات الأولية قد كشفوا بالفعل عن بنية البروتونات.
- تصنف الباريونات على أنها جسيمات تتكون أساسًا من ثلاث جسيمات أولية تسمى الكواركات.
2- النيوترونات
- النيوترونات هي جسيمات دون ذرية توجد في نوى جميع العناصر باستثناء الهيدروجين.
- نظرًا لأن نواتها تحتوي على بروتون واحد فقط، فإن النيوترون ليس له شحنة وتبلغ كتلته 1.67493 × 10-27 كجم، أي أنه أثقل قليلاً من البروتون.
- هذا يعادل 1839 ضعف الكتلة الإلكترونية، البروتونات والنيوترونات تسمى نيوكليونات، لأنها محصورة في مساحة ضيقة وكثيفة تمثل 99.9٪ من الكتلة الذرية، فإنها تسمى نوى.
- مثل البروتونات، كانت النيوترونات الجسيم الرئيسي حتى نهاية القرن الماضي من قبل علماء فيزياء الجسيمات، ومثل البروتونات، تعتبر النيوترونات جزءًا من باريون يحتوي على ثلاثة كواركات.
- وتجدر الإشارة أيضًا إلى أنه على الرغم من عدم وجود جسيمات سالبة فيه، إلا أنه لا يزال يحتفظ بتماسك النواة، ولكن الجسيمات المحايدة والجسيمات الموجبة هي فقط ما يسمى بالقوى النووية القوية.
- وهي تتجاوز قوة التنافر المتبادلة للبروتونات الموجبة وتحافظ على تماسك النواة.
3- الإلكترونات
- الإلكترونات هي جسيمات دون ذرية ذات شحنة قلوية سالبة وتعتبر جسيمات أولية، بما أنه لا يحتوي على مكونات بالداخل، فلا يمكن تجزئته، ولا توجد إلكترونات أخف منه في الذرة.
- كتلة الإلكترون هي 9.10938356 × 10-31 كجم.
- لا يتم حساب هذه الكتلة عند حساب الكتلة الذرية لأنها صغيرة جدًا، تم اكتشاف الإلكترونات بواسطة JJ Thomson، أثناء دراسة أشعة الكاثود، وقد ساهم هذا الاكتشاف بشكل كبير في فهم التركيب الذري.
- تتواجد الإلكترونات حول النواة وتوزع عند مستويات طاقة مختلفة، فعندما تُزال الإلكترونات من مداراتها حول النواة، تأين الذرات تسمى أيونات.
- يمكن أن تتواجد الإلكترونات بحرية مع الأيونات في حالة الأيونات، في تصنيف علماء الجسيمات الأولية، تنتمي الإلكترونات إلى مجموعة الفرمون (بالإنجليزية: fermions)، ويتم وصف سلوكها بواسطة تعداد ديراك فيرمي.
النموذج الذري
- تتكون معظم المواد من جزيئات، والفصل بين هذه الجسيمات سهل نسبيًا، تتكون الجزيئات من ذرات مرتبطة ببعضها البعض عن طريق روابط كيميائية.
- ويصعب الفصل بينها، وتتكون كل ذرة من إلكترونات ونواة، وترتبط هذه الإلكترونات والنواة كهربائيًا، فهي تتحد معا.
- من أجل فصلها عن بعضها البعض، يتطلب ذلك إعطاء قدر كبير من الطاقة للإلكترونات حتى تتمكن من الهروب ومغادرة مداراتها، والالكترونات والنوى (البروتونات والنيوترونات) هي جسيمات دون ذرية ذات أعمار طويلة.
- وهذا يعني، على عكس الجسيمات دون الذرية الأخرى، أن تحللها يستغرق وقتًا طويلاً نسبيًا، لأن الحصول عليها يتطلب طاقة عالية جدًا، ولا يستغرق سوى وقت قصير لتتحلل إلى جسيمات أخرى أكثر استقرارًا.
الخصائص الرئيسية للذرات
- العدد الذري: يعتبر العدد الذري من أهم خصائص الذرة، يمثل عدد الشحنات الموجبة الموجودة في النواة، أي البروتونات (أيضًا عدد الإلكترونات في الذرات المحايدة).
- على سبيل المثال، العدد الذري للكربون هو 6، والعدد الذري لليورانيوم هو 92، وبما أن عدد الإلكترونات مرتبط بالتفاعلات الكيميائية، فإن العدد الذري مهم جدًا عند الحديث عن التفاعلات الكيميائية.
- الكتلة الذرية: يؤثر عدد النيوترونات في النواة على كتلة الذرة، لكنه لا يؤثر على خصائصها الكيميائية.
- على سبيل المثال، سيكون لذرة الكربون التي تحتوي على 6 بروتونات و 6 نيوترونات نفس الخصائص الكيميائية نظير الكربون الذي يحتوي على 6 بروتونات و8 نيوترونات.
- ويكون الاختلاف فقط في كتلة النظيرين، في حين أن يمثل العدد الكتلي مجموع الأعداد الخاصة بالبروتونات والنيوترونات.
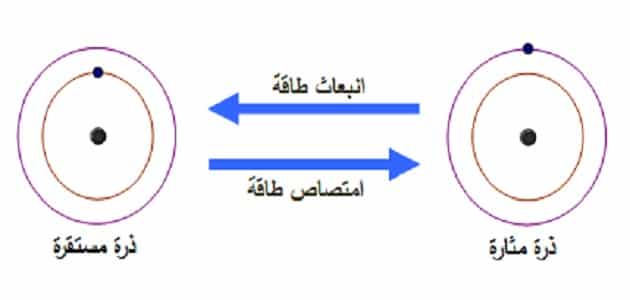
الذرة المثارة
- الحالة المثارة في الفيزياء الذرية هي حالة النظام الكمومي (مثل الذرة أو الجزيء أو النواة، حيث تكون طاقة النظام أعلى من الحالة السفلية).
- على سبيل المثال، تتميز الذرة، مثل ذرة الهيدروجين، بأن الإلكترون يدخل المدار عند مستوى طاقة كمي معين، وعادة ما يستقر في مستوى كمي يسمى الحالة السفلية، حيث تكون طاقته هي الحد الأدنى المطلق.
- إذا امتص الإلكترون فوتونًا من الخارج، فإن طاقة الفوتون الممتص قد تكون كافية لجعل الإلكترون يترك مستوى طاقته الكمومية ويرفع إلى مستوى طاقة أعلى، وتسمى حالة الذرة الحالة المثارة.
- في حالة الإثارة، لا يمكن للإلكترون البقاء في حالة الإثارة لفترة طويلة، وبالتالي فإن الإلكترون سيطلق طاقته الزائدة بسرعة إلى الخارج في شكل فوتونات (مثل إشعاع الضوء) وينخفض إلى الحالة المستقرة السفلية.
الاستقرار ومدة العمر
- إذا تم التعامل معه كنظام فيزيائي منعزل، إذن وفقًا لما نراه في الطبيعة فإنه يميل إلى تقليل طاقته إلى الحد الأدنى، تشرح ميكانيكا الكم هذه الخاصية من خلال تغيير إمكانية مستويات الطاقة الكمومية، ويمكن للنظام إطلاق أحدها.
- لذلك، عادةً ما تكون الحالة المثارة غير مستقرة، ولكنها مرتبطة بمدة الحالة المثارة.
- بمعنى أنه يمكن القول إن العمر يشير إلى احتمال التحلل في غضون ثانية واحدة من انتقال النظام من حالة الإثارة إلى حالة الإثارة المنخفضة أو الحالة اللانهائية.
- يمكن أن يكون العمر جزءًا من الثانية (حزمة الانبعاث)، أو يمكن أن يتحلل بيتا وغاما على مدى آلاف السنين.
طرق إثارة الإلكترونات في الذرة
- امتصاص الفوتون: يمكنك إثارة الإلكترونات ونقلها إلى مستويات طاقة أعلى عن طريق امتصاص فوتونات ذات أطوال موجية محددة، والتي تتناسب مع مستوى الطاقة المراد نقلها.
- ولكن يجب أن تمتص الإلكترونات فوتونات ذات أطوال موجية محددة، إنها ليست أكثر من طاقة مستوى الطاقة، فعندما يثير الإلكترون نفس الفوتون بنفس الطول الموجي، فإنه ينخفض إلى مستوى طاقة أقل.
- الاصطدام: قد يتسبب تصادم العنصر والإلكترون في انتقال الإلكترون بين مستوى الطاقة الأدنى ومستوى الطاقة الأعلى، وعادةً ما يكون هذا بسبب الطاقة الحركية بين الذرات المتصادمة.
- لذلك ينتقل إلى الإلكترونات و يثيرها انتقل إلى مستوى طاقة آخر، في الواقع قد يتسبب هذا في طرد الإلكترونات تمامًا من الذرة، وهذا التأثير يسمى “تأمين التأثير”.
- ولكن من أجل حدوث الإثارة، والتي ستؤدي إلى انتقال الإلكترونات بين مستويات الطاقة المختلفة، يجب الحصول على مستوى طاقة، الطاقة النوعية المناسبة، والتي تتناسب مع الطاقة التي سينشرها الإلكترون.
- باستخدام درجة الحرارة لتحفيز الاصطدام بين العناصر والإلكترونات.
أهمية تحفيز الإثارة في الإلكترونات
- تساعد عملية إثارة الإلكترونات داخل الذرات في تحديد التركيب الكيميائي للمادة، ويمكن القيام بذلك عن طريق فحص طيف الضوء المنبعث عند المرور عبر منشور.
- من خلال فحص التركيب الكيميائي لهذه الأطياف، يمكننا معرفة المزيد عن مستويات الطاقة وخصائص الذرات، وهو أمر مفيد للبحث والفهم الواسع لهذه الجسيمات الصغيرة وتطبيقاتها في الحياة.
طيف الانبعاث الذري
- عندما يتم تسخين مادة ما إلى درجة حرارة عالية، فإنها ستصدر ضوء وتنبعث منها طيفًا مستمرًا.
- عندما يتحقق مطياف (محلل ضوئي) من الطيف المستمر، يطلق عليه مطياف.
- وجدنا أنها مكونة من عدة ألوان متداخلة لا حدود بينها.
- عندما يتم تسخين غاز أو بخار مادة إلى درجة حرارة عالية تحت ضغط منخفض
- أو من خلال شرارة كهربائية، سوف يتوهج.
- عند فحصه باستخدام مطياف، وجدنا أنه يتكون من عدد محدود من الخطوط الملونة (تسمى الطيف الخطي).
الطيف الخطي
- الطيف الخطي: “يشير إلى العدد المحدد للخطوط الملونة الناتجة عن التسخين من غاز منخفض الضغط إلى درجة حرارة عالية.”
- الطيف الخطي لأي عنصر هو ميزته الأساسية، لأنه لا يوجد عنصرين لهما نفس الطيف الخطي.
- هذا مثل بصمة الإصبع التي يمكن أن تميز أي شخص.
- من خلال دراسة الطيف الخطي لأشعة الشمس، وجد أنه يتكون أساسًا من الهيدروجين والهيليوم.
- من خلال دراسة طيف الانبعاث الخطي لذرات الهيدروجين، تمكن بور من بناء نموذجه الذري.
نموذج بور لتـركيب الذرة النموذج الإلكتروستاتيكي
- كان بور قادرًا على تطوير نموذج رذرفورد للتركيب الذري.
- إن دوران الإلكترونات حول النواة لا يتعامل مع افتراضات نيوتن الديناميكية الكلاسيكية كما فعل ماكسويل.
- قاده هذا إلى حقيقة أن الإلكترونات ستشع بشكل دائم عندما تدور حول النواة، مما يؤدي إلى انهيار الذرة.
فروض بور
استخدم بور افتراضات رذرفورد حول التركيب الذري، وهي:
- يوجد في وسط الذرة نواة موجبة الشحنة.
- عدد البروتونات الموجبة في النواة يساوي عدد الإلكترونات السالبة التي تدور حول النواة.
- عندما تدور الإلكترونات حول النواة، تتولد قوة الطرد المركزي بسبب سرعة دوران الإلكترون.
- إنها تساوي قوة الجاذبية الناتجة عن جاذبية الإلكترون للنواة.
- تتحرك الإلكترونات بسرعة حول النواة دون أن تفقد أو تكتسب أي طاقة.
- تدور الإلكترونات حول النواة عند مستويات طاقة محددة وثابتة
- تعتبر المسافة بين مستويات الطاقة هذه منطقة ممنوعة تمامًا من دوران الإلكترون.
- تمتلك الإلكترونات كمية معينة من الطاقة عند التحرك حول النواة، والتي تتوقف على مسافة من مستوى طاقة الذرة وتزداد مع زيادة نصف القطر.
- استخدم عددًا صحيحًا يسمى رقم الكم الاساسي لتمثيل طاقة كل مستوى، يأخذ العدد الصحيح الرقم (1 → 7) أو الرمز (K، L، M، N، O، P، Q).
- في حالة الاستقرار: “إنها الحالة الأقل طاقة والأكثر استقرارًا لذرة أو جزيء أو أيون”.
- هذه هي أقل طاقة متاحة للإلكترونات المتبقية.
- في الحالة المثارة: حالة تحصل فيها الإلكترونات على كمية معينة من الطاقة من خلال التسخين أو التفريغ، بعد ذلك، تصل الإلكترونات المثارة مؤقتًا إلى مستوى طاقة أعلى (اعتمادًا على الكسب).
- الإلكترون في حالة غير مستقرة على المستوى العلوي وسيعود قريبًا إلى مستواه الأصلي.
- ستفقد الطاقة المكتسبة وتعود إلى مستواها الأصلي.
- يتم توليد هذه الطاقة كإشعاع ضوئي بأطوال موجية وترددات مختلفة، وتنتج أطياف خطية مختلفة.
لقد ناقشنا في مقالة اليوم ما هي الذرة المثارة؟، كما تحدثنا عن الذرة ككل والبروتونات والنيوترونات والإلكترونات سالبة الشحنة، وأيضا عن الطيف الذري وطريقة الحصول عليه للإلمام بهذا الموضوع من جميع جوانبه.